|
 |
Das in der Animation dargestellte Modell zur F0-Funktion basiert auf einer Hypothese des deutschen Biophysikers Wolfgang Junge ("ATP synthase: an electrochemical transducer with rotatory mechanics", Trends in Biochemical Sciences, 1997). Diese Hypothese wird unter anderem durch folgende Beobachtungen gestützt:
- Für die Bildung von ATP ist ein Protonengradient über der Membran erforderlich.
- In aktiven Enzymen rotiert der F0c-Komplex.
- Experimente weisen darauf hin, dass in einer Untereinheit von F0c die Protonierung und Deprotonierung der Aminosäure Asparaginsäure in Position 61 (ASP 61) eine beträchtliche Änderung der Struktur dieser Untereinheit auslösen könnte.
- In der F0a-Untereinheit führt der Austausch der basischen Aminosäure Arginin in Position 210 (ARG 210) zum totalen Funktionsverlust der ATP-Synthase.
- Zwischen der Aminosäure ASP 61 von F0c und dem Bereich von F0a, der die Aminosäure ARG 210 trägt, wurde ein Kontakt nachgewiesen.

Aufgaben
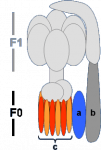
| Der nur zehn Nanometer (1 Nanometer = 1 Millionstel Millimeter) große F0c-Komplex wird oft als das "älteste Rad der Welt" bezeichnet. Beobachte den Weg eines Protons während einer Rad-Umdrehung. Die Grafik neben der Animation zeigt einen Schnitt durch den F0c-Komplex auf Höhe der Aminosäuren ASP 61 und ARG 210. Klicke auf der Seite F0-Struktur "Schnittebene" an und verdeutliche dir die Lage dieser Aminosäuren im dreidimensionalen Modell. |
|
| Aus welchem zellulären Kompartiment müssen die Protonen stammen und wohin werden sie transportiert? Hinweise zur Beantwortung der Frage sind auf der Seite zur Lokalisierung der ATP-Synthase zu finden. Welche Kraft treibt das molekulare "Mühlrad" an? Beschreibe den Weg der Protonen und den hypothetischen Mechanismus, der dem F0c-Rotationsmodell zu Grunde liegt, möglicht genau. |